Dr. Marc Esser, Dr. Juliane Schreier, Dr. Bastian Thaa (veröffentlicht in Pharmazeutische Medizin 2018;20(2):68-75)
Gesundheitsbezogene Lebensqualität in der frühen Nutzenbewertung: Stellenwert, Evidenznachweis und Auswertung aktueller Verfahren
Die gesundheitsbezogene Lebensqualität wird in der frühen Nutzenbewertung wichtiger. Wir geben eine Einführung in die Thematik, vergleichen den Stellenwert der gesundheitsbezogenen Lebensqualität zwischen Zulassung und frühen Nutzenbewertung und diskutieren aktuelle G-BA-Beschlüsse.
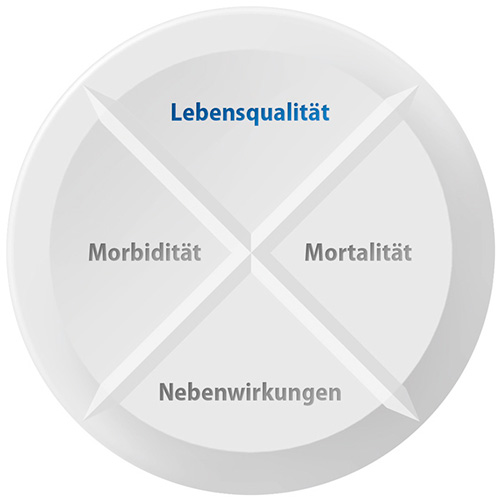
Stellenwert der gesundheitsbezogenen Lebensqualität in der frühen Nutzenbewertung
Das primäre Therapieziel in der Medizin hat sich bei vielen Erkrankungen von der Heilung mehr in Richtung Erhalt der Lebensqualität verschoben, da immer mehr ältere und chronisch kranke Patienten behandelt werden. Entsprechend wird die Forderung von gesundheitspolitischen Stakeholdern formuliert, dass auch in der frühen Nutzenbewertung nach §35a SGB V die gesundheitsbezogene Lebensqualität einen größeren Stellenwert bekommen sollte. Bereits jetzt wird die Lebensqualität von Patienten am Ende des Lebens vom G-BA höher bewertet als eine marginale Verlängerung der Lebenszeit1. So heißt es beispielsweise im Beschluss zu Necitumumab: »Unter Berücksichtigung eines nur geringfügigen positiven Effekts auf das Gesamtüberleben wiegt in der Gesamtbewertung schwer, dass kein Vorteil hinsichtlich der für den Patienten belastenden Symptomatik vorliegt und zudem keine Aussagen zur Lebensqualität getroffen werden können bei zugleich zu berücksichtigenden Nachteilen bei den Nebenwirkungen«2.
In den Beratungsgesprächen beim G-BA wird regelmäßig an die pharmazeutischen Unternehmen appelliert, belastbare Daten zur Lebensqualität vorzulegen. Doch was versteht man unter Lebensqualität genau? Die gesundheitsbezogene Lebensqualität (Health-Related Quality of Life, HRQoL) ist ein multidimensionales Konstrukt aus physischen, psychischen und sozialen Dimensionen (Abb. 1)3. Im Vergleich zur allgemeinen Lebensqualität ist das Konstrukt der gesundheitsbezogenen Lebensqualität enger definiert, da z.B. die finanzielle Situation der Betroffenen unberücksichtigt bleibt. Während Daten zur gesundheitsbezogenen Lebensqualität für die Arzneimittelzulassung eher ergänzenden Charakter haben, werden solche Daten für die frühe Nutzenbewertung neben den patientenrelevanten Endpunkten zu Mortalität, Morbidität und Nebenwirkungen generell als gleichrangiges Nutzenkriterium angesehen. Die Lebensqualität wird bei der frühen Nutzenbewertung anders als beispielsweise in Großbritannien (NICE Appraisal) nicht mit der Lebenszeit zu »qualitätsadjustierten Lebensjahren« (QALYs) verrechnet.
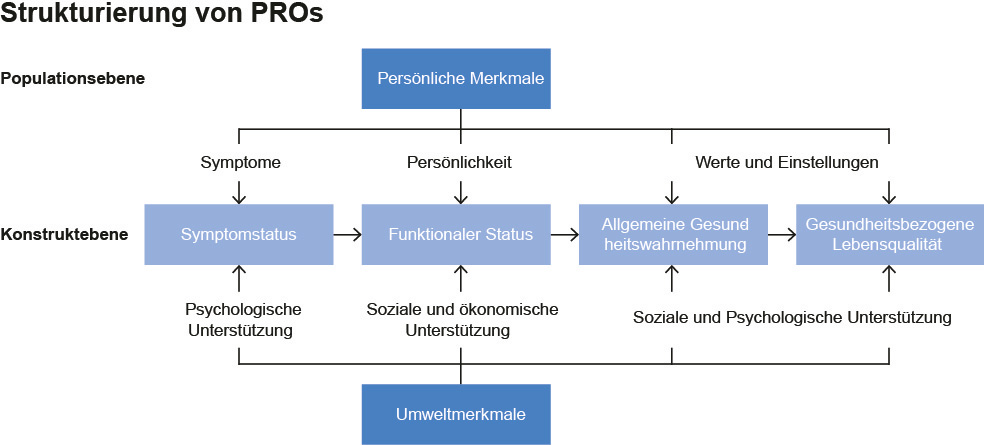
Abb. 1: Die Dimensionen der gesundheitsbezogenen Lebensqualität nach Wilson und Cleary
Verhältnis von gesundheitsbezogener Lebensqualität und Patient Reported Outcomes
Die gesundheitsbezogene Lebensqualität gehört zur Gruppe der Patient Reported Outcomes (PROs) und zählt zu den am häufigsten erhobenen PROs. Das wesentliche Charakteristikum von PROs ist das subjektive Berichten durch den Patienten, wodurch die Patientenperspektive stärker in der Evaluation einer Therapie berücksichtigt wird, was gesellschaftlich zunehmend stärker gefordert wird (Patient Empowerment). Im Vergleich zur gesundheitsbezogenen Lebensqualität ist die Definition von PROs umfassender, es können auch andere Symptome oder Domänen abgefragt werden, solange sie direkt durch den Patienten berichtet werden4.
Evidenznachweis von gesundheitsbezogener Lebensqualität
G-BA und IQWiG stellen an den Evidenznachweis für die gesundheitsbezogene Lebensqualität grundsätzlich die gleichen Anforderungen wie an andere Endpunkte, es werden also randomisierte, kontrollierte Studien gefordert. Da die gesundheitsbezogene Lebensqualität naturgemäß subjektiv ist, wird hierbei unverblindeten Studien ein hohes statistisches Verzerrungspotential zugeschrieben5, 6.
Zur Steigerung der Aussagekraft sollten individuelle Patienten-Differenzen erhoben werden – dies ermöglicht Responderanalysen. Solche Responderanalysen sind von Vorteil gegenüber einer reinen Analyse von Mittelwertunterschieden zwischen Behandlungsgruppen, wo nicht nach einzelnen Patienten differenziert wird. Als Kriterium für Responderanalysen hat sich die klinische Relevanzschwelle bzw. »minimal important difference« (MID) etabliert – dabei handelt es sich um den kleinsten Unterschied, der als klinisch relevant wahrgenommen wird. Die MID sollte im Vorfeld festgelegt, gut begründet und insbesondere validiert sein. Manchmal werden je nach Validierungsstudie mehrere, verschieden stringente MIDs für Responderanalysen herangezogen.
Die Methodik der Validierung von MIDs wird zunehmend kritisch diskutiert – auch für Validierungsstudien wird eine hohe Qualität gefordert. So sollte das Patientenkollektiv groß genug sein, um Veränderungen adäquat zu erfassen, und die Veränderung des Gesundheitszustandes im Verlauf der Studie sollte hinreichend groß sein, um Aussagen treffen zu können. Es steht also zu befürchten, dass es zunehmend schwerer wird, auf Basis von kleineren oder älteren Studien eine MID zu begründen. So hat das IQWiG jüngst die Validierungsstudie für das bewährte Instrument FKSI-DRS (zur Erfassung der Lebensqualität beim Nierenzellkarzinom) als nicht mehr geeignet zur MID-Festlegung angesehen und daher die darauf basierenden Responderanalysen nicht anerkannt7. Der G-BA hat allerdings diese Responderanalysen in den Nutzenbewertungsverfahren zu Cabozantinib und Tivozanib (April 2018) trotzdem zur Beurteilung der Symptomatik herangezogen, aus Analogiegründen zu früheren Verfahren8, 9. Es ist im Augenblick noch unklar, ob die methodische Diskussion zu den Kriterien für Validierungsstudien dazu führen könnte, dass möglichst international anerkannte Standards erarbeitet werden.
Auswahl von geeigneten Messinstrumenten
Unterscheiden lassen sich grundsätzlich allgemeine bzw. generische und krankheitsspezifische Instrumenten. Generische Instrumente zielen krankheitsübergreifend darauf ab, alle relevanten Domänen der gesundheitsbezogenen Lebensqualität zu erfassen. Hierdurch sind die Fragebögen sehr umfangreich und für den Patienten entsprechend zeitaufwendig. Im Vergleich zu generischen Instrumenten haben krankheitsspezifische Instrumente eine höhere Sensitivität bei der Messung der gesundheitsbezogenen Lebensqualität, da ihre Fragen auf bestimmte Erkrankungen, Populationen oder Zustände zugeschnitten sind. Die am häufigsten in Nutzendossiers zur Erfassung von gesundheitsbezogener Lebensqualität eingesetzten Instrumente sind nach einer Analyse von Borchert et al. EQ-5D (57%), SF-36 (32 %) und EORTC-QLQ (21 %). Während SF-36 und EORTC-QLQ in jeweils etwa einem Drittel der Fälle zur Erteilung eines Zusatznutzen im Beschluss führten, war das bei EQ-5D nur in 7% aller Fälle so, da der EQ-5D von G-BA und IQWiG zur Erfassung der Lebensqualität regelhaft nicht anerkannt wird; die visuelle Analogskala EQ-5D VAS wird als Morbiditäts-Endpunkt bewertet10.
Alle Instrumente müssen in jedem Fall in einer validierten Version in der jeweiligen Patientensprache vorliegen, was vor allem bei globalen Studien eine Herausforderung bedeuten kann. Im Studiendesign ist die gesundheitsbezogene Lebensqualität so wie andere PROs in der Regel ein sekundärer Endpunkt.
Insgesamt nimmt das Angebot an Instrumenten ständig zu. Die Datenbank PROQOLIDTM (https://eprovide.mapi-trust.org) listet gegenwärtig (Datenbankabfrage am 14.05.2018) 1635 Instrumente für die gesundheitsbezogene Lebensqualität und andere PROs auf. In der aktuellen PRO-Forschung werden deshalb viele Instrumente vergleichend untersucht, um Hilfe für die Auswahl des bestgeeigneten Instrumentes zu geben.
Steigerung der Rücklaufquote
Damit die Erfassung der gesundheitsbezogenen Lebensqualität als adäquat eingestuft wird, sollte die Rücklaufquote laut IQWiG mindestens 80 % betragen, was aber häufig nicht oder zumindest nicht zu jedem Befragungszeitpunkt erreicht wird. Geringe Rücklaufquoten führen in der Bewertung durch das IQWiG zur Zuschreibung eines hohen Verzerrungspotentials, sodass selbst bei signifikanten und klinisch relevanten Verbesserungen in der Aussage zur Ergebnissicherheit meist nur ein »Anhaltspunkt« zuerkannt wird.
Es gibt viele Möglichkeiten, die Rücklaufquoten zu optimieren. Hierzu gehören die bessere Motivation von Patienten und Interviewern, die Verwendung von möglichst kurzen und dem Gesundheitszustand des Patienten angemessenen Fragebögen, frankierte Rückumschläge bei postalischen Befragungen, personalisierte Begleitschreiben usw. Die Verwendung krankheitsspezifischer Instrumente reduziert den Befragungsaufwand und steigert die Rücklaufquote, da krankheitsspezifische Fragen vom Patienten besser akzeptiert werden. Besonders bei generischen Instrumenten sind manche Fragen nach dem Gesundheitszustand hingegen nicht angemessen – etwa die Frage an einen bettlägerigen Krebspatienten im finalen Stadium, wie schwer ihm längere Spaziergänge fallen. Solche Fragen sind für den Patienten frustrierend und reduzieren daher die Motivation, die Fragen zu beantworten, was eine geringe Rücklaufquote zur Folge hat.
In der Zukunft sollen Computer-Adaptive Tests (CAT) dazu beitragen, das Problem der zu geringen Rücklaufquote mithilfe von Webtechnologien zu lösen11. Das Prinzip von CAT ist, dass dem Patienten nur Fragen präsentiert werden, die zu seinem bisherigen Antwortverhalten bzw. Krankheitszustand passen. Außerdem werden dabei die bekannten Verzerrungen durch »Deckeneffekte« und »Bodeneffekte« konventioneller Instrumente reduziert, indem bevorzugt Items im vermuteten mittleren Ausprägungsbereich präsentiert werden. Inwieweit CAT von IQWiG und G-BA künftig akzeptiert werden, ist noch fraglich.
Die gesundheitsbezogene Lebensqualität in der Zulassung
Daten zur gesundheitsbezogenen Lebensqualität waren bisher für die Zulassung nicht verpflichtend und hatten eher ergänzenden Charakter. Allerdings betont die EMA inzwischen den Stellenwert solcher Daten und gibt detaillierte Anweisungen zur Umsetzung12. Die Anforderungen hinsichtlich Studiendesign, Messung usw. unterscheiden sich nicht wesentlich im Vergleich zu denen von G-BA und IQWiG. Unternehmen, die in der Fachinformation beanspruchen, eine Verbesserung in der gesundheitsbezogenen Lebensqualität zu erreichen, sollen »robuste Daten« in allen oder zumindest den meisten der eingesetzten Messinstrumente vorlegen. Die EMA weist darauf hin, dass eine erreichte Verbesserung in der gesundheitsbezogenen Lebensqualität nicht zu Lasten der Wirksamkeit gehen darf, beispielsweise durch Dosisreduktionen. Zusammenfassend lässt sich sagen, dass der entscheidende Unterschied zwischen Zulassung und HTA darin besteht, dass auf alleiniger Basis der gesundheitsbezogenen Lebensqualität zwar ein Zusatznutzen ausgesprochen werden kann, aber keine Zulassung.
Stellenwert der gesundheitsbezogenen Lebensqualität in aktuellen Verfahren der frühen Nutzenbewertung
Die gesundheitsbezogene Lebensqualität wird in klinischen Studien immer häufiger ermittelt. Diese Daten gehen aber oft aufgrund methodischer Mängel nicht in die Nutzenbewertung ein. Die häufigsten Kritikpunkte sind zu geringe Rücklaufquoten, eine fehlende Validierung oder unzureichende Nachbeobachtung. Um herauszufinden, wie häufig Lebensqualitätsdaten vorgelegt werden und wo die Hürden liegen, haben wir alle Verfahren ausgewertet, die zwischen dem 01.01.2017 und dem 30.04.2018 abgeschlossen wurden (N=73). In immerhin 57 von 73 (78 %) Nutzenbewertungsverfahren wurden Daten zur Lebensqualität vorgelegt (Abb. 2). Im Vergleich zum Jahr 2017 allein ist das eine Steigerung von 5 %, gegenüber dem Jahr 2013 eine Steigerung von 9 %. Dabei wurden im Beobachtungszeitraum 01.01.2017–30.04.2018 in Verfahren zu Orphan Drugs etwas häufiger Daten zur gesundheitsbezogenen Lebensqualität berichtet (in 18 von 22 Verfahren, 82 %) als in Verfahren zu Nicht-Orphan Drugs (in 38 von 51 Verfahren, 75 %). In 21 der insgesamt 55 Dossiers mit Daten zur gesundheitsbezogenen Lebensqualität (38 %) wurde mehr als ein Fragebogen verwendet. In diesem Fall wurden mehrheitlich – wie vom G-BA gewünscht – ein generischer und ein krankheitsspezifischer Fragebogen eingesetzt (14 der 21 Verfahren). In 5 Verfahren wurden mehrere generische Fragebögen und in 2 Verfahren mehrere krankheitsspezifische Fragebögen ausgewählt. Insgesamt wurden als generische Fragebögen am häufigsten der EORTC-QLQ-C30 (generisch, aber krebsspezifisch; N=26) und der SF-36 (N=10) eingesetzt. Diese Fragebögen wurden vom G-BA fast immer akzeptiert, es sei denn, die Rücklaufquoten waren zu gering oder die MID für die Responderanalysen wurde nicht korrekt hergeleitet. Auffällig ist, dass der EQ-5D noch in 7 Dossiers als Lebensqualitätsfragebogen vorgelegt wurde, obwohl dieser vom G-BA in der Domäne Lebensqualität nicht mehr akzeptiert wird.
Bei näherer Betrachtung zeigt sich, dass in einigen Indikationen anteilig häufiger Daten zur gesundheitsbezogenen Lebensqualität vorgelegt wurden als in anderen. So enthielt in den Verfahren der Indikationen Dermatologie (N=4 im ausgewählten Zeitraum) und Muskel-Skelett-System (N=3) jedes Dossier Daten zur gesundheitsbezogenen Lebensqualität. In der Indikation Onkologie (N=41) lagen immerhin in 83 % der Dossiers Lebensqualitätsdaten vor, in der Indikation Stoffwechsel (N=4) in 75 %. In den Bereichen Nervensystem (N=4, 50 %), Verdauungssystem (N=2, 50 %) und Infektiologie (N=10, 40 %) legten die pharmazeutischen Unternehmen im untersuchten Zeitraum seltener Daten zur gesundheitsbezogenen Lebensqualität vor (Abb. 3). Diese Unterschiede könnten damit zusammenhängen, dass Lebensqualität in einigen Indikationen für Patienten und Ärzte eine größere Rolle in der Therapieentscheidung spielt und hierzu zunehmend Daten verlangt und erhoben werden. Dazu gehören dermatologische sowie onkologische Erkrankungen. Auch ist in der Onkologie die Krankheitsdauer häufig kürzer und die Nachbeobachtungszeit daher geringer, was sich günstig auf die Rücklaufquoten bei den Fragebögen auswirken kann. Dagegen werden bei chronischen Erkrankungen längere Nachbeobachtungszeiten gefordert. Die Patienten langfristig zu erreichen und zum Ausfüllen der Fragebögen zu motivieren ist mit großen Anstrengungen verbunden und lässt sich nicht immer realisieren, sodass möglicherweise auf die Erhebung von Lebensqualitätsdaten gänzlich verzichtet wird. Dennoch ist die Lebensqualität gerade bei chronischen Erkrankungen wichtig, und Daten dazu werden vom G-BA gefordert.
Werden Daten zur gesundheitsbezogenen Lebensqualität vorgelegt, ist das noch keine Garantie für die Akzeptanz beim G-BA, aber unsere Auswertung zeigt, dass es sich dennoch lohnt, Mühe in die korrekte Erfassung der Lebensqualität zu investieren: Im ausgewählten Zeitraum hat der G-BA die Lebensqualitätsdaten in 30 von 55 Verfahren (55 %), in denen Daten vorgelegt wurden, für die Nutzenbewertung berücksichtigt. Dieser Wert findet sich auch in der indikationsbezogenen Betrachtung wieder. In jeder Indikation außer Stoffwechsel wurden in jeweils mindestens 50 % der Verfahren mit vorgelegten Lebensqualitätsdaten diese Daten vom G-BA auch akzeptiert (Abb. 4).
Wichtigste Gründe für die Ablehnung von Lebensqualitätsdaten waren ungeeignete Vergleiche oder mangelhafte Studiendesigns (40 %), fehlende Validität des verwendeten Lebensqualitätsfragebogens (24 %) oder zu geringe Rücklaufquoten (20 %). Sonstige Gründe waren fehlende Aktualität des verwendeten Lebensqualitätsfragebogens, Verwendung von Fragebögen, die zur Messung der Lebensqualität als nicht geeignet eingestuft werden, fehlende Schwellen für die klinische Relevanz und fehlender Bezug zur ITT-Population. Diese Auswertung macht deutlich, dass die Lebensqualitätsdaten oft deswegen nicht akzeptiert wurden, weil die Studie an sich wegen Mängeln im Studiendesign nicht akzeptiert wurde (zum Beispiel einarmige Studien).
Weiterhin geht aus unserer Auswertung hervor, dass im untersuchten Zeitraum in 9 Verfahren die Lebensqualität jeweils gegenüber der zweckmäßigen Vergleichstherapie statistisch signifikant besser war und zusammen mit anderen Endpunkten zu einem besseren Zusatznutzen geführt hat (Tab. 1). In 17 anderen Verfahren unterschied sich die Lebensqualität nicht statistisch signifikant zwischen dem zu bewertenden Arzneimittel und der zweckmäßigen Vergleichstherapie.
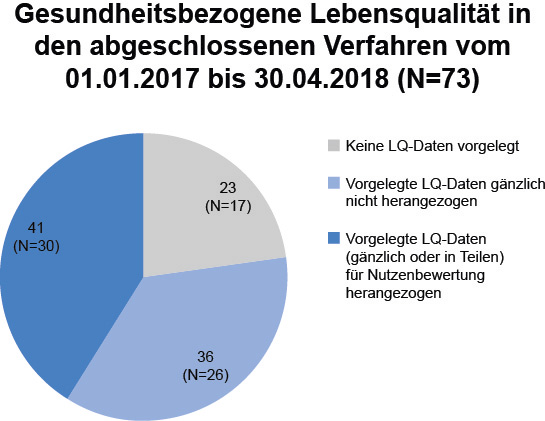
Abbildung 2: Gesundheitsbezogene Lebensqualität (LQ) in aktuellen Verfahren der frühen Nutzenbewertung. Auswertung auf Basis der Dossiers, Beschlüsse, Tragenden Gründe und Wortprotokolle im Auswertungszeitraum vom 01.01.2017 bis zum 30.04.2018. LQ: Lebensqualität
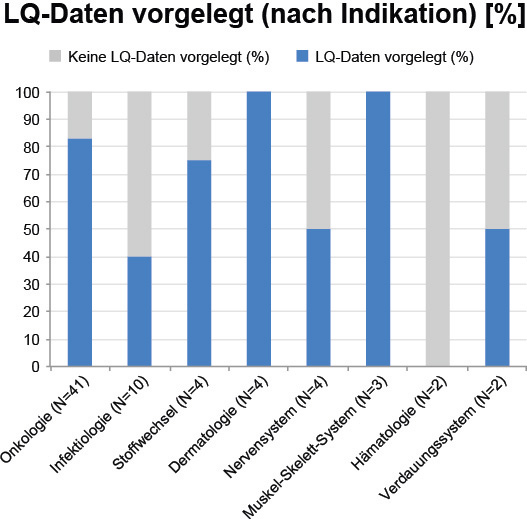
Abbildung 3: Prozentsatz der Verfahren mit Darstellung von Daten zur gesundheitsbezogenen Lebensqualität je nach Indikation. Berücksichtigt sind alle Indikationen im untersuchten Zeitraum mit ≥2 Verfahren. In den Indikationen Atmungssystem, Herz-Kreislauf und Sonstiges gab es im Auswertungszeitraum nur jeweils ein Verfahren. Daten zur Lebensqualität wurden für diese Indikationen nicht vorgelegt. LQ: Lebensqualität
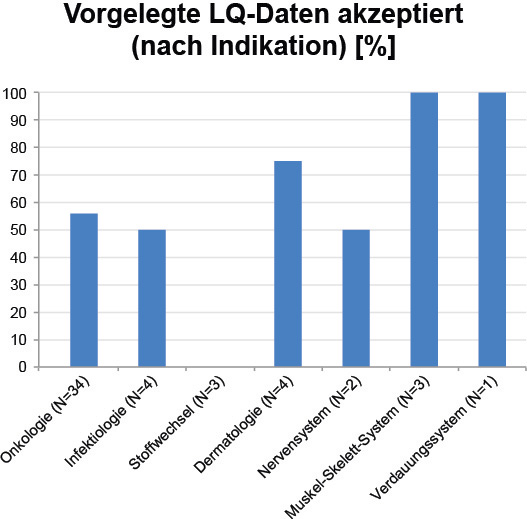
Abbildung 4: Akzeptanz der vorgelegten LQ-Daten je nach Indikation. Berücksichtigt sind alle Indikationen im untersuchten Zeitraum mit mindestens einem Verfahren, das Daten zur Lebensqualität enthält (vgl. Abb. 2). LQ: Lebensqualität
Fazit: Der G-BA legt bei der Beurteilung eines möglichen Zusatznutzens großen Wert auf valide Daten zur gesundheitsbezogenen Lebensqualität. Gelingt es, passende und validierte Instrumente einzusetzen, die geforderten Rücklaufquoten zu erfüllen und geeignete Vergleiche darzulegen, werden die Daten zur gesundheitsbezogenen Lebensqualität mit hoher Wahrscheinlichkeit akzeptiert und können sich günstig auf den Zusatznutzen auswirken.
| Wirkstoff | Indikation (Anwendungsgebiet*) | Orphan ja/nein | Höchster Zusatznutzen | Referenz |
| Brodalumab | Dermatologie (Plaque-Psoriasis) | nein | Nicht quantifizierbar | 13 |
| Carfilzomib (erneute Nutzenbewertung, Überschreitung 50-Mio.-€-Grenze) | Onkologie (Multiples Myelom) | ja | Beträchtlich | 14 |
| Carfilzomib (neues Anwendungsgebiet: Multiples Myelom in Kombination mit Dexamethason) | Onkologie (Multiples Myelom) | ja | Gering | 15 |
| Ceritinib (Neubewertung nach Fristablauf) | Onkologie (Lungenkarzinom) | nein | Beträchtlich | 16 |
| Ixekizumab | Dermatologie (Plaque-Psoriasis) | nein | Beträchtlich | 17 |
| Osimertinib (Neubewertung nach Fristablauf) | Onkologie (Lungenkarzinom) | nein | Beträchtlich | 18 |
| Pembrolizumab (neues Anwendungsgebiet: NSCLC, Erstlinie) | Onkologie (Lungenkarzinom) | nein | Beträchtlich | 19 |
| Sarilumab | Muskel-Skelett-System (Rheumatoide Arthritis) | nein | Beträchtlich | 20 |
| Secukinumab (Neubewertung nach Fristablauf) | Dermatologie (Plaque-Psoriasis) | nein | Beträchtlich | 21 |
Tabelle 1: Verfahren, in denen die Lebensqualität gegenüber der zweckmäßigen Vergleichstherapie statistisch signifikant besser war und zusammen mit anderen Endpunkten zu einem besseren Zusatznutzen geführt hat (N=9).
Quellen:
1 Müller T: Lebensqualität in der frühen Nutzenbewertung – Sichtweise des G-BA. 2017. Verfügbar unter https://www.vfa-patientenportal.de/download/praesentation-mueller
2 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Necitumumab, Tragende Gründe zum Beschluss: Verfügbar unter: https://www.g-ba.de/downloads/40-268-3974/2016-09-15_AM-RL-XII_Necitumumab_D-221_TrG.pdf
3 Wilson IB, Cleary PD: Linking clinical variables with health-related quality of life. A conceptual model of patient outcomes. JAMA. 1995 Jan 4;273(1):59-65
4 Valderas JM, Alonso J: Patient reported outcome measures: a model-based classification system for research and clinical practice. Quality of Life Research 2008; 17(9):1125-1135
5 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Allgemeine Methoden. Version 5.0 vom 10.07.2017. Verfügbar unter: https://www.iqwig.de/de/methoden/methodenpapier.3020.html
6 Gemeinsamer Bundesausschuss (G-BA): Verfahrensordnung vom 17.11.2017. Verfügbar unter: https://www.g-ba.de/downloads/62-492-1554/VerfO_2017-11-17_iK-2018-04-12.pdf
7 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (neues Anwendungsgebiet: Nierenzellkarzinom), Wortprotokoll der mündlichen Anhörung. Verfügbar unter: https://www.g-ba.de/downloads/91-1031-323/2018-02-19_Wortprotokoll_Cabozantinib_D-317.pdf
8 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (Neubewertung nach Fristablauf). Tragende Gründe zum Beschluss vom 5. April 2018. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4917/2018-04-05_AM-RL-XII_Cabozantinib_D-317_TrG.pdf
9 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Tivozanib. Tragende Gründe zum Beschluss vom 19. April 2018. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4941/2018-04-19_AM-RL-XII_Tivozanib_D-323_TrG.pdf
10 Borchert K, Altevers J, Braun S, Mittendorf T et al.: The value of patient reported outcomes in German AMNOG dossiers. Poster präsentiert beim ISPOR, Wien 2017; 29.10.–2.11.2016
11 Joeris A: Neue Wege in der Erhebung von Patient Reported Outcomes. Orthopädie und Unfallchirurgie – Mitteilungen und Nachrichten 2016; 05(02): 138-139
12 European Medicines Agency (EMA): Reflection Paper on the use of patient reported outcome 4 (PRO) measures in oncology studies. Verfügbar unter: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2014/06/WC500168852.pdf
13 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Brodalumab. Tragende Gründe zum Beschluss vom 1. März 2018. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4854/2018-03-01_AM-RL-XII_Brodalumab_D-309_TrG.pdf
14 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Carfilzomib (erneute Nutzenbewertung, Überschreitung 50-Mio.-€-Grenze). Tragende Gründe zum Beschluss vom 15. Februar 2018. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4802/2018-02-15_AM-RL-XII_Carfilzomib_D-302_TrG.pdf
15 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Carfilzomib (neues Anwendungsgebiet: multiples Myelom in Kombination mit Dexamethason). Tragende Gründe zum Beschluss vom 19. Januar 2017. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4157/2017-01-19_AM-RL-XII_Carfilzomib_nAWG-Kombi-Dexamethason_D-255_TrG.pdf
16 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Ceritinib (Neubewertung nach Fristablauf). Tragende Gründe zum Beschluss vom 16. März 2017. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4603/2017-10-19_AM-RL-XII_Ceritinib_D-259_TrG.pdf
17 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Ixekizumab. Tragende Gründe zum Beschluss vom 17. August 2017. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4526/2017-08-17_AM-RL-XII_Ixekizumab_D-275_TrG.pdf
18 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Osimertinib (Neubewertung nach Fristablauf). Tragende Gründe zum Beschluss vom 19. Oktober 2017. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4602/2017-10-19_AM-RL-XII_Osimertinib_D-282_TrG.pdf
19 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Pembrolizumab (neues Anwendungsgebiet: nicht-kleinzelliges Lungenkarzinom, Erstlinie). Tragende Gründe zum Beschluss vom 3. August 2017. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4514/2017-08-03_AM-RL-XII_Pembrolizumab_D274_TrG.pdf
20 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Sarilumab. Tragende Gründe zum Beschluss vom 15. Februar 2018. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4803/2018-02-15_AM-RL-XII_Sarilumab_D-299_TrG.pdf
21 Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Secukinumab (erneute Nutzenbewertung). Tragende Gründe zum Beschluss vom 17. August 2017. Verfügbar unter: https://www.g-ba.de/downloads/40-268-4527/2017-08-17_AM-RL-XII_Secukinumab_D-276_TrG.pdf